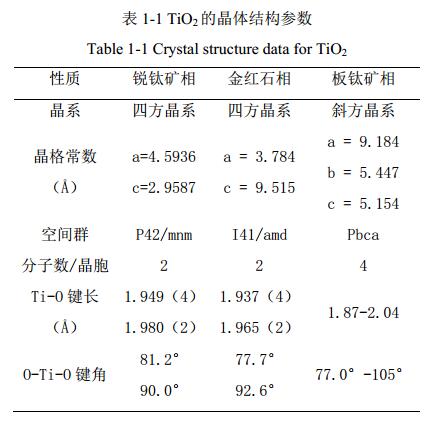
二氧化钛有三种矿物形式:锐钛矿、金红石和板钛矿。 锐钛矿相二氧化钛的结构属于四方晶系, 其中每个八面体与周围 8 个八面体相连接( 4 个共边, 4 个共顶角), 4 个 TiO2 分子组成一个晶胞(图 ( b) ), 主要用于紫外光照射下的光催化剂。 由于高电子迁移率、低介电常数和低密度, 锐钛矿二氧化钛在太阳能电池应用中很受欢迎。 金红石相二氧化钛也是四方晶系, Ti 原子位于晶格中心, 6 个氧原子位于八面体的棱角上, 每个八面体与周围 10 个八面体相连(其中有八个共顶角,两个共边),两个 TiO2 分子组成一个晶胞( 图 ( a) )。 金红石相在大多数的温度和压力下都比较稳定。 作为催化剂来讲,金红石相二氧化钛的活性是非常低的,所以其主要用作涂料中的白色颜料。 板钛矿二氧化钛属于斜方晶系, 6 个 TiO2 分子组成一个晶胞。 因为板钛矿相晶体结构很不稳定,所以在自然界中存在比较稀少。
三种晶相中金红石相是最稳定的, 锐钛矿相和板钛矿相经过加热处理后会发生不可逆的放热反应, 最终转变为金红石相。
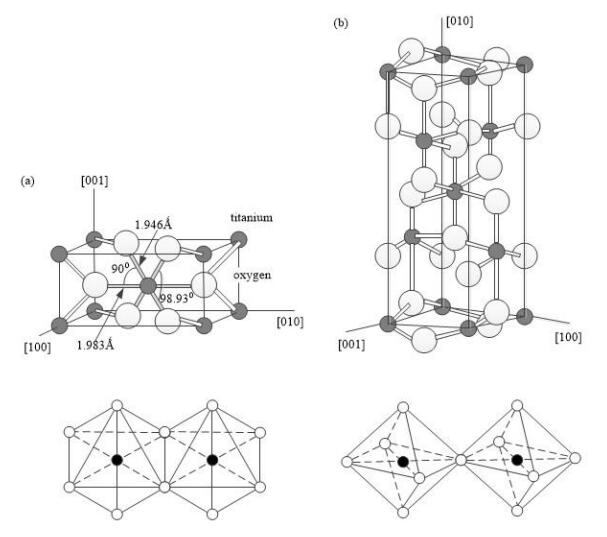
图 1 TiO2 的晶体结构参数:( a)金红石相,( b)锐钛矿相
二氧化钛是宽能带半导体材料,其锐钛矿相、金红石相和板钛矿相的禁带宽度分别是 3.2 eV、 3.02 eV 和 2.96 eV。 TiO2 的价带由 Ti 的 3d 轨道和与之杂化的 O 的 2p 轨道组成, 而导带只有 Ti 的 3d 轨道。 当用波长小于等于 387 nm 的光照射 TiO2时,其价带上的电子就会被激发进入到导带,形成带负电的高活性电子 e-,同时在价带上形成带正点的空穴 h+,即电子-空穴对, 如图 2 所示。
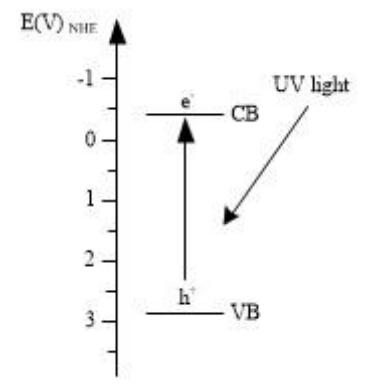
图 2 TiO2 光照反应机制
二氧化钛属于过渡金属氧化物,其相对密度与其结晶形态、粒径大小、化学组分有关。 金红石相是二氧化钛最稳定的结晶形态, 致密的结构使其与锐钛矿相比具有更高的硬度、密度、介电常数与折光率。 锐钛矿型二氧化钛的相对密度 3.8~3.9 g/cm3,金红石型二氧化钛的相对密度为 4.2~4.3 g/cm3。 由于金红石相二氧化钛单位晶格由两个二氧化钛分子组成,所以相比其由四个二氧化钛分子组成的锐钛矿相二氧化钛来讲,其单位晶格较小且更紧密, 所以具有较大的稳定性和相对密度, 因此具有较高的折射率和和介电常数及较低的热传导性。
由于二氧化钛的介电常数较高,因此具有优良的电学性能。在外电场的作用下,其离子之间相互作用,形成了极强的局部内电场。在这个内电场的作用下,离子外层电子轨道发生了强烈变形,离子本身也随之发生了很大位移。二氧化钛晶型所含微量杂质等都对介电常数影响很大。金红石型的介电常数随二氧化钛晶体的方向而不同:当与 C 轴相平行时,测得其介电常数 180;呈直角时为 90;其粉末平均值为 114。锐钛型二氧化钛的介电常数只有 48。
二氧化钛具有半导体的性能,其电导率随温度的上升而迅速增加,而且对缺氧也非常敏感。如金红石型二氧化钛在 20 ℃时还是绝缘体,但加热到 420 ℃时电导率增加了 107 倍;按化学计量组成的二氧化钛( TiO2)电导率<10-10 s/m,而当二氧化钛失去少量氧时, 如 TiO1.9995 的电导率却有 10-1s/m。电子工业常利用金红石相二氧化钛的介电常数和半导体性质来生产陶瓷电容器等电子元器件。二氧化钛无毒,化学性质很稳定,常温下几乎不与其他物质发生反应,是一种偏酸性的两性氧化物。与氧、硫化氢、二氧化硫、二氧化碳和氨都不起反应,也不溶于水、脂肪酸和其他有机酸及弱无机酸,微溶于碱和热硝酸,只有在长时间煮沸条件下才能完全溶于浓硫酸和氢氟酸。
纳米二氧化钛( TiO2)作为一种光催化剂,是一种性能优良的 N 型半导体纳米材料, 可以充分利用太阳能,既高效节能又环保,并且在发生反应时表现出较好的光稳定性和较高的反应活性, 无毒,成本廉价, 无二次污染,是当前应用前景最为广阔的一种纳米功能材料。 被广泛应用于废水处理、空气净化、杀菌消毒、医疗技术和制备环保型材料等领域。







