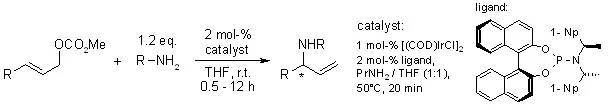
A. Leitner, C. Shu, J. F. Hartwig, Org. Lett., 2005, 7, 1093-1096.
Pd(0)-催化剂对双键进行配位得到η2π-烯丙基络合物。然后氧化加成,在此过程中离去基团离去,得到 η3 π-烯丙基络合物。此过程也被称为离子化过程:
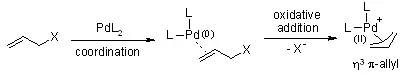
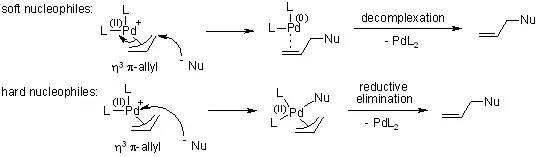
根据亲核试剂的强度,此反应可能经过两种不同反应历程。弱亲核试剂(Soft nucleophiles,其共轭酸的pKa < 25)直接加成到烯丙基片段上。而强亲核试剂(ard nucleophiles)首先进攻金属中心,接着还原消除得到烯丙基化合物:
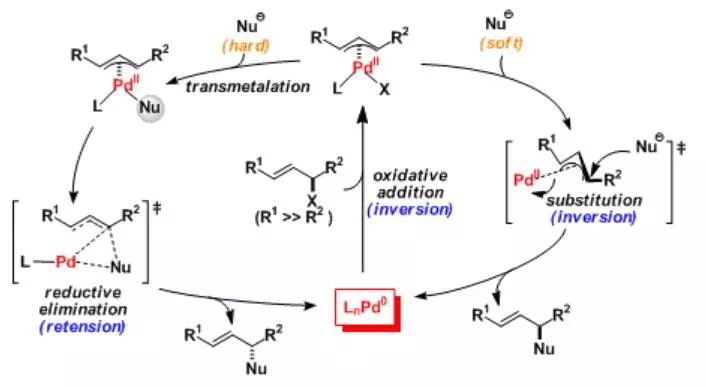
这两种反应机理模型对于不对称的Tsuji-Trost 反应有至关重要的影响。对于这方面的讨论,可以参阅Trost 和 Vranken 的研究(Chem. Rev., 1996, 96, 395. DOI)。
对于烯丙基底物,通常不活泼的酯或是碳酸酯更利于发生氧化加成。这是由于氧化加成的最开始而言,在参与配位的双键旁边有定位基团对钯的插入更加有利。
通常在氧化加成的步骤和亲核进攻的步骤里整体构型都会发生反转,全过程发生两次反转因此产物还是保持了原来的构型。值得一提的是在用硬亲核试剂的情况下,反应机理则是硬亲核试剂与钯的转移金属化接着还原消去的顺序进行。在这一亲和加成的阶段构型将会保持,反映总体而言生成物的构型将会发生反转。
不对称的烯丙基底物一般在位阻较小的一侧进行取代,空间选择性也和亲核试剂的大小有关:
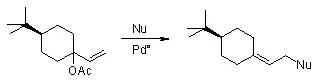
空间位阻较小的亲核试剂(如苯酚)得到空间上更加拥挤的产物。
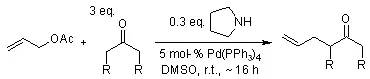
【Angew. Chem. Int. Ed., 2006, 45, 1952-1956.】
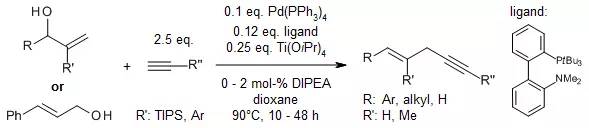
【, 2013, 135, 12536-12539.】
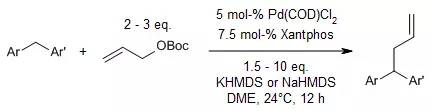
【, 2013, 135, 17602-17609.】
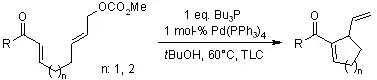
【, 2003, 125, 7758-7759.】
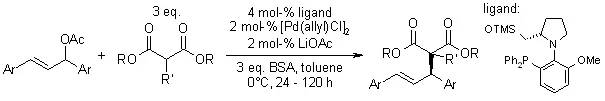
【, 2004, 69, 6679-6687.】
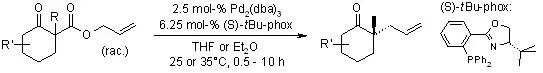
【Angew. Chem. Int. Ed., 2005, 44, 6924-6927.】
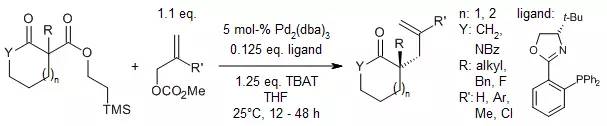
【Org. Lett., 2014, 16, 2314-2317.】
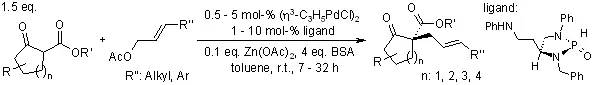
【, 2004, 126, 3690-3691.】
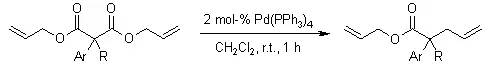
【, 2007, 72, 1534-1537.】
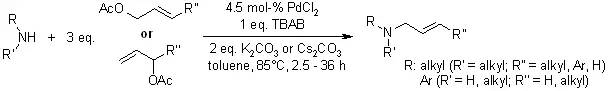
【, 2009, 74, 3982-3985.】
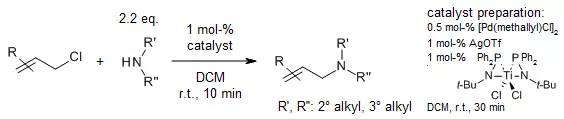
【Org. Lett., 2015, 17, 752-755.】
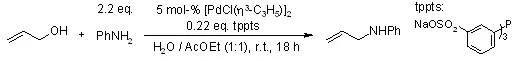
【Org. Lett., 2004, 6, 4085-4088.】
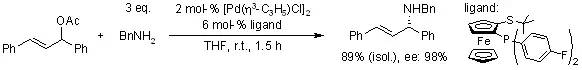
【, 2003, 68, 3679-3686.】
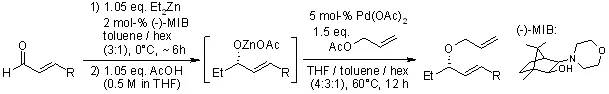
【, 2006, 128, 4232-4233.】
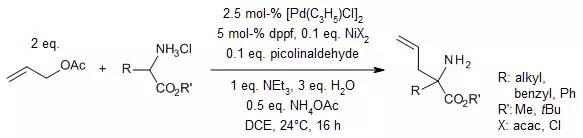
【Org. Lett., 2012, 14, 2130-2133.】
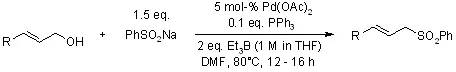
【, 2005, 70, 6506-6507.】
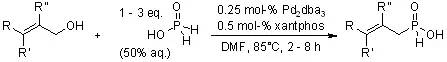
【Org. Lett., 2006,8, 4169-4171.】
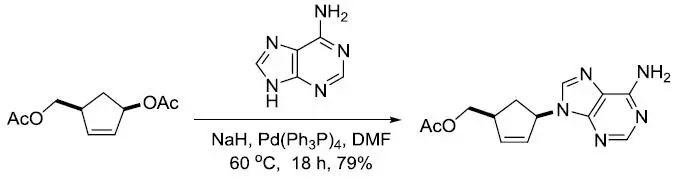
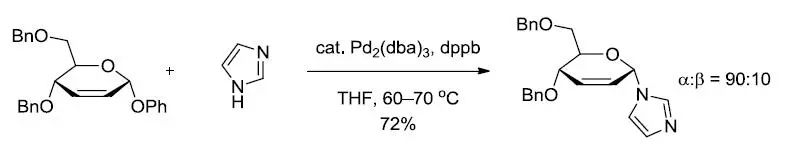
【Tetrahedron Lett. 1992, 33, 2481–2484】
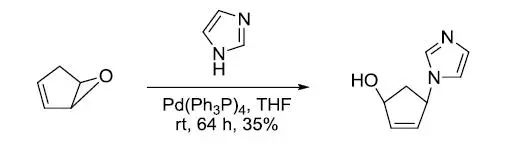
【J. Heterocycl. Chem. 1997, 34, 233-239】
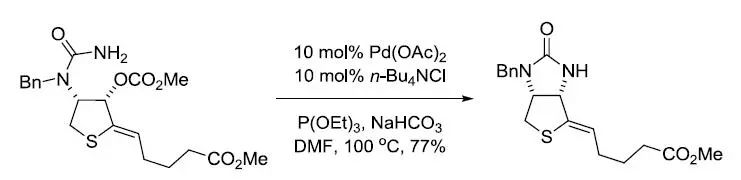
【J. Org. Chem. 2002, 67, 5527-5536】
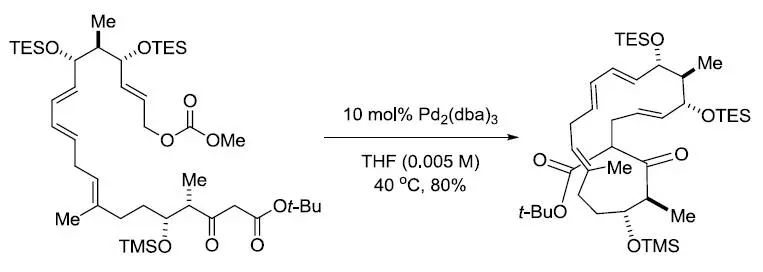
【J. Am. Chem. Soc. 2003,125, 5393-5407】
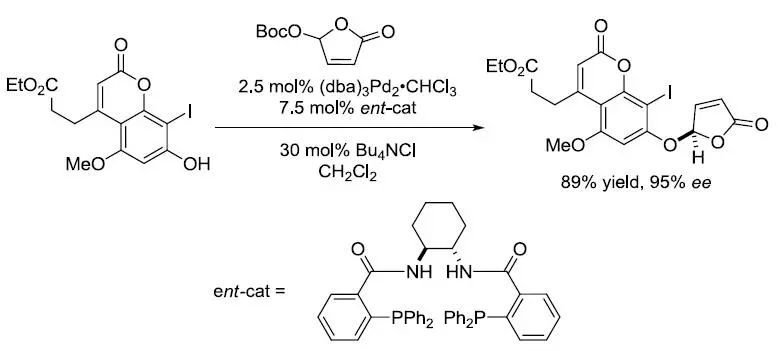
【J. Am. Chem. Soc.2003, 125, 3090-3100】
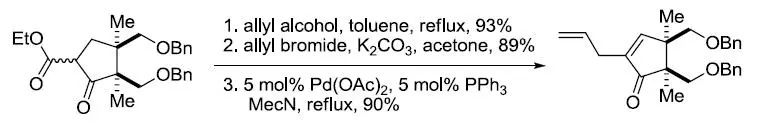
【Org. Biomol. Chem. 2013, 11, 4750–4756】
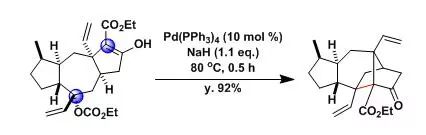
【J. Am. Chem. Soc. 2006, 128, 6931】







