叔丁氧羰基(Boc)是目前多肽合成中广为采用的氨基保护基,特别是在固相合成中,氨基的保护用Boc而多不用Cbz。Boc具有以下的于的优点:
Boc-氨基酸除个别外都能得到结晶;
易于酸解除去,但有具有一定的稳定性,Boc-氨基酸能较长期的保存而不分解;
酸解时产生的是叔丁基阳离子再分解为异丁烯,它一般不会带来副反应;
对碱水解、肼解和许多亲核试剂稳定;
Boc对催化氢解稳定,但比Cbz对酸要敏感得多。当Boc和Cbz同时存在时,可以用催化氢解脱去Cbz,Boc保持不变,或用酸解脱去Boc而Cbz不受影响,因而两者能很好地搭配。
叔丁氧羰基的导入
游离氨基在用NaOH 或NaHCO3 控制的碱性条件下用二氧六环和水的混合溶剂中很容易同Boc2O反应得到N-叔丁氧羰基氨基化合物。这是引入Boc常用方法之一,它的优点是其副产物无多大干扰并容易除去。有时对一些亲核性较大的胺,一般可在甲醇中和Boc酸酐直接反应即可,无须其他的碱,其处理也方便。
对水较为敏感的氨基衍生物,采用Boc2O/TEA/MeOH or DMF 在40-50℃下进行较好,因为这些无水条件下用于保护O17标记的氨基酸而不会由于与水交换使O17丢失。有空间位阻的氨基酸而言,用Boc2O/Me4NOH.5H2O/CH3CN是十分有利的。
芳香胺由于其亲核性较弱,一般反应需要加入催化剂,另外对于伯胺,通过DMAP的使用可以上两个Boc.
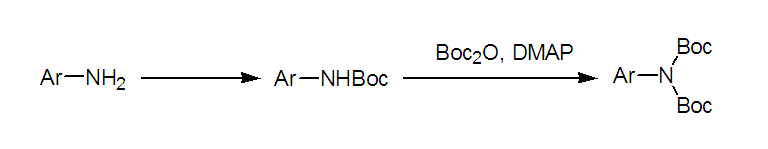
对于有酚羟基存在的胺,酚羟基上接Boc的速度也是相当快的,因而一般没太大的选择性。 对于有醇羟基存在的,若用DMAP做催化剂,时间长了以后醇羟基也能上Boc, 因此反应尽量不要过夜。
由于氰酸酯的生成,有位阻的胺往往会与Boc2O生成脲。这个问题可通过该胺NaH或NaHMDS反应,然后再与Boc2O反应来加以避免。
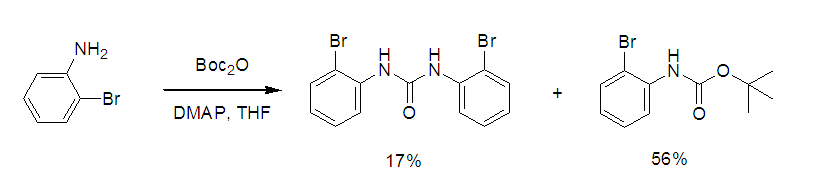
有时在反应中有可能多加了Boc酸酐,当分子中无游离酸碱时很难出去,若一定要除去,一般在体系中加入一些N,N-二甲基乙二胺或N,N-二甲基丙二胺,而后将上了Boc的N,N-二甲基乙二胺或N,N-二甲基丙二胺用稀酸除去。
由于Boc对酸敏感,因此在合成过程中用到酸洗或酸溶解等操作时,为了保险起见,尽量不用盐酸而用10%柠檬酸(0.5M)或在低温条件进行。
2.2.2 叔丁氧羰基的脱去
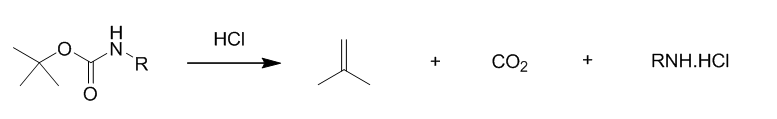
Boc比Cbz对酸敏感,酸解产物为异丁烯和CO2(见下式)。在液相肽的合成中,Boc的脱除一般可用TFA或50%TFA(TFA:CH2Cl2 = 1:1,v/v)。而在固相肽合成中,由于TFA会带来一些副反应(如在得到的胺上上一个三氟乙酰基等),因此多采用1-2M HCl/有机溶剂。一般而言用HCl/二氧六环,比较多见。
用甲醇作溶剂,HCl/EtOAc的组合使TBDMS和TBDPS酯以及叔丁酯和非酚类酯在Boc脱除时不被断裂,而S-Boc除外。但当同时脱除分子中Boc和叔丁酯, 或分子中有游离羧酸基,千万记住不能用HCl/MeOH,其可将羧酸变为甲酯。同时AcCl/MeOH,则是一个在甲醇中产生无水HCl的便利方法。这些条件也可用来从羧酸制备酯以及形成胺的盐酸盐。
在中性的无水条件下Me3SiI在CHCl3或CH3CN中除了能脱除Boc外,也能断裂氨基甲酸酯、酯、醚和缩酮。通过控制条件可以得到一定的选择性。
当分子中存在一些官能团其可与副产物叔丁基碳正离子在酸性下反应时,需要添加硫酚(如苯硫酚)来清除叔丁基碳正离子,如此举可防止蛋氨酸和色氨酸的脱Boc时的烷基化。也可使用其它的清除剂,如苯甲醚、苯硫基甲醚、甲苯硫酚、甲苯酚及二甲硫醚。在Boc脱去过程中TBDPS和TBDMS基对CF3COOH是稳定的(在TBS存在,用相对稀一些的10-20 %TFA)。伯胺衍生物存在下,ZnBr2/CH2Cl2可以选择性的脱除仲胺上的Boc。







