在化学中,异构体是具有相同配方但具有不同结构的离子或分子。异构体不一定具有相似的性质。异构的两种主要形式是结构异构(或构成异构)和立体异构(或空间异构)。
词源
异构体(/ aɪ 小号əm ər / ;从希腊ἰσομερής,种异构体 ; ISO文件 = “相等”,MEROS = “部分”)是“异构体”的根。术语是由瑞典化学家杜撰JONS雅各布贝齐里乌斯(1779年至1848年)在1830年[2] 异构(/ aɪ š ə 米ə ˌ ř ɪ Ž əm,
结构异构体

不同类型的异构体,包括左侧的位置异构体2-氟丙烷和1-氟丙烷
在结构异构体中,原子和官能团以不同方式连接在一起。结构异构体具有不同的IUPAC名称,可以或可以不属于同一官能团。[3]该组包括链异构,其中烃链具有可变量的支化; 位置异构,它处理链上的一个功能组的位置; 和官能团异构,其中一个官能团分裂成不同的官能团。
例如,两个位置异构体是2-氟丙烷和1-氟丙烷,如上图左侧所示。
互变异构体是结构异构体,即使在纯净时也会相互自发地相互转化。它们具有不同的化学性质,因此,观察到每种形式特有的不同反应。如果相互转化反应足够快,则互变异构体不能相互隔离。一个例子是当它们的质子位置不同时,例如酮/烯醇互变异构,其中质子交替地位于碳或氧上。
例子:丙醇和甲氧基乙烷
异丙醇的简单例子由丙醇给出:它具有式C 3 H 8 O(或C 3 H 7 OH)并且以两种异构体出现:丙-1-醇(正丙醇; I)和丙烷-2 -ol(异丙醇; II)
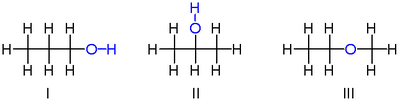
注意,氧原子的位置在两者之间不同:它与第一异构体中的末端碳连接,在第二异构体中与中心碳连接。
然而,存在另一种具有显着不同性质的C 3 H 8 O异构体:甲氧基乙烷(乙基 – 甲基 – 醚; III)。与丙醇的异构体不同,甲氧基乙烷具有与两个碳连接的氧,而不是与一个碳和一个氢连接的氧。甲氧基乙烷是醚,而不是醇,因为它缺少羟基,并且其化学性质与其他醚类似,与上述任何一种醇异构体相似。
示例:丙二烯和丙炔
丙二烯(或丙二烯)和丙炔(或甲基乙炔)是含有不同键类型的异构体的实例。丙二烯含有两个双键,而丙炔含有一个三键。

丙二烯 |
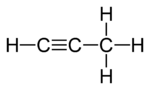
丙炔 |
立体异构体
在立体异构体中,键结构是相同的,但原子和空间中的官能团的几何定位不同。这一类包括对映体,其是彼此的非叠加的镜像图像,以及非对映体,哪些不是。对映异构体通常含有手性中心和非对映异构体,但有一些非对映异构体既不是手性的也不含有手性中心。[4]另一种类型的异构体,构象异构体(构象异构体),可以是旋转异构体,非对映异构体或对映异构体,这取决于确切的化合物。例如,邻位锁定的联苯系统具有对映体。
在双键处具有受限旋转的E / Z异构体是构型异构体。它们被归类为非对映异构体,无论它们是否含有任何手性中心。[4] E / Z表示法描述了绝对立体化学,它是基于CIP优先级的明确描述符。
“顺式 – 反式异构体”用于描述分子中具有受限旋转的任何分子。对于具有C = C双键的分子,这些描述符仅基于基团体积或主要碳链描述相对立体化学,因此可以是模糊的。对于具有多于两个取代基的双键,这尤其成问题。顺反异构的一个过时术语是“几何异构”。[5]对于具有两个以上取代基的烯烃,使用EZ表示法代替顺式和反式。如果可能,在具有两个取代基的化合物中也优选E和Z(以斜体形式书写)。[6]
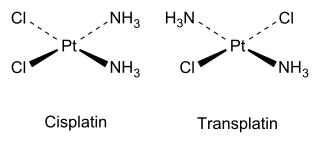
两种异构体复合物,顺铂和移植物
顺式和反式异构体也存在于无机配位化合物中,例如方形平面 MX 2 Y 2配合物和八面体 MX 4 Y 2配合物。相关类型的几何异构是八面体MX 3 Y 3络合物中的面 – 经向(fac-mer)异构,其中每组三个相同的配体占据八面体的一个面或位于八面体的一个子午线上。
注意,尽管构象异构体可以称为立体异构体,但它们不是稳定的异构体,因为构象异构体中的键可以容易地旋转,从而将一种构象异构体转化为另一种构象异构体,其可以是原始构象异构体或非对映异构体。
虽然结构异构体通常具有不同的化学性质,但立体异构体在大多数化学反应中表现相同,除了它们与其他立体异构体的反应。然而,酶可以区分化合物的不同对映体,并且生物体通常优选一种异构体而不是另一种。
对映异构体在偏振光的旋光方向上不同,因此有时将其描述为光学异构体。[7] [8]然而,该术语定义不明确,也被用于描述其他立体异构体以及对映体。[9]它的使用,因此强烈反对,并且分子应替代地描述为对映异构体或非对映体作为合适的。[10] [9]
异构化
异构化是将一个分子转化为具有完全相同原子的另一个分子但重新排列原子的过程。[11]在某些分子和某些条件下,异构化是自发发生的。许多异构体的键能相等或大致相等,因此它们以大致相等的量存在,条件是它们可以相对自由地相互转化,即两种异构体之间的能垒不太高。当异构化在分子内发生时,它被认为是重排反应。
一个的示例的有机金属异构化是生产decaphenylferrocene的,[(η 5 -C 5 博士5)2从其铁] 键异构体。[12] [13]
- 富马酸的合成
富马酸的工业合成通过马来酸的顺式 – 反式异构化进行:
药物化学
具有不同医学性质的异构体是常见的; 例如,甲基的位置。在取代的黄嘌呤中,巧克力中的可可碱是一种血管扩张剂,与咖啡因有一些共同作用; 但是,如果两个甲基中的一个移动到双环核心上的不同位置,则异构体是茶碱,其具有多种作用,包括支气管扩张和抗炎作用。另一个例子发生在基于苯乙胺的兴奋剂药物中。芬特明是一种非手化合物的效果比安非他明的效果弱。它被用作减少食欲的药物,具有轻微或无刺激性。然而,不同的原子排列给出了右旋安非他明,这是一种比安非他明更强的兴奋剂。
在药物化学和生物化学中,对映体是一个特别关注的问题,因为它们可能具有完全不同的生物活性。许多制备方法提供等量的两种对映体形式的混合物。在一些情况下,使用手性固定相通过色谱法分离对映体。它们也可以通过形成非对映体盐来分离。在其他情况下,已经开发了对映选择性合成。
作为无机实例,顺铂(参见上述结构)是用于癌症化学疗法的重要药物,而反式异构体(转移酶)没有有用的药理学活性。
历史
异构最早在1827注意到,当弗里德里希·维勒制备氰酸银和发现的是,虽然它的元素组成是相同的雷酸银(由制备贾斯特斯冯李比希前一年),[14]其性质是完全不同的。这一发现挑战了对时间的普遍化学理解,认为化学化合物只有在具有不同的元素组成时才会有所不同。在进行了相同类型的其他发现之后,例如Woehler的1828年发现尿素具有与化学上不同的氰酸铵相同的原子组成,JönsJacobBerzelius在1830年引入了异构现象来描述这种现象。[15]
| {\ displaystyle {\ ce {^ { – } \!C {\ equiv} {\ overset {+} {N}} – O ^ { – }}}} | 的雷酸盐离子由原子C,N,和O的布置的Ñ作为被绑定到每个其他两个的中间原子。 |
|---|---|
| {\ displaystyle {\ ce {^ {\ ominus} \!OC {\ equiv} N}}} | 相比之下,氰酸根离子由原子N,C和O组成,其中C作为中间原子排列,其与另外两个中的每一个结合。 |
1848年,路易斯巴斯德将酒石酸分离成两种镜像形式的微小晶体。[16] [17]的每个的单独的分子是左和右光学立体异构体,溶液,其的转动平面的偏振光的光以相同的程度,但方向相反。
其他类型的异构
在此范围之外存在其他类型的异构现象。一般情况下,拓扑称为异构体拓扑异构是风约并形成不同的形结或环的大分子。具有拓扑异构体的分子包括catenanes和DNA。拓扑异构酶可以结合DNA,从而改变其拓扑结构。还存在同位素异构体或同位素异构体,其具有相同数量的每种类型的同位素取代但在化学上不同的位置。在核物理学中,核异构体是原子核的激发态。旋转异构体具有不同的自旋分布 在它们的组成原子中。










