手性醇及其衍生结构广泛存在于多种生物活性分子和天然产物中。烯丙基金属试剂对羰基化合物进行亲核加成可以构建高烯丙醇结构,一直以来都得到人们的广泛关注。尽管该策略在手性醇的合成中发挥着重要的作用,但需要在反应前预制备超化学计量的烯丙基金属试剂,该制备过程往往需要严格的手性控制,以确保进一步烯丙基化反应的立体选择性。此外,简单的亲核试剂如烯丙基、巴豆基或肉桂基金属试剂能很好地参与反应,但合成复杂的烯丙基金属试剂往往面临着较大的难题。反应过程中通常需要使用强碱攫氢,由此限制了底物中酸性及极性基团的修饰。过渡金属Ir、Ru和Ni等催化的烯丙基金属物种对不饱和键的加成引起了研究者的密切关注,但底物局限于醛和特殊结构的酮类化合物,对于普通的酮则无能为力。
美国麻省理工学院(MIT)的Stephen Buchwald教授(点击查看介绍)课题组一直致力于不饱和化合物氢铜化原位形成有机铜亲核试剂的研究,用于对亲电试剂亚胺及酮类底物的加成反应。最近,为了实现高效地合成手性高烯丙醇化合物,他们按照图1B的设计思路,在J. Am. Chem. Soc. 上报道了膦配体配位的CuH物种可与联烯作用形成烯丙基铜活性物种,随后对酮进行不对称亲核加成得到手性高烯丙醇产物。该方法对于含有敏感官能团的酮及联烯底物也具有良好的适用性,反应主要得到包含支链的产物,与基于亲核试剂对亚胺亲核加成的理论计算结果相符。

Stephen Buchwald教授。图片来源:MIT
作者认为,要想顺利实现图1B的催化过程,CuH对联烯的加成速率需快于酮直接发生还原的速率。催化循环中CuH物种的再生可通过烷氧基铜物种与氢化硅烷发生复分解或者与醇进行配体交换实现。
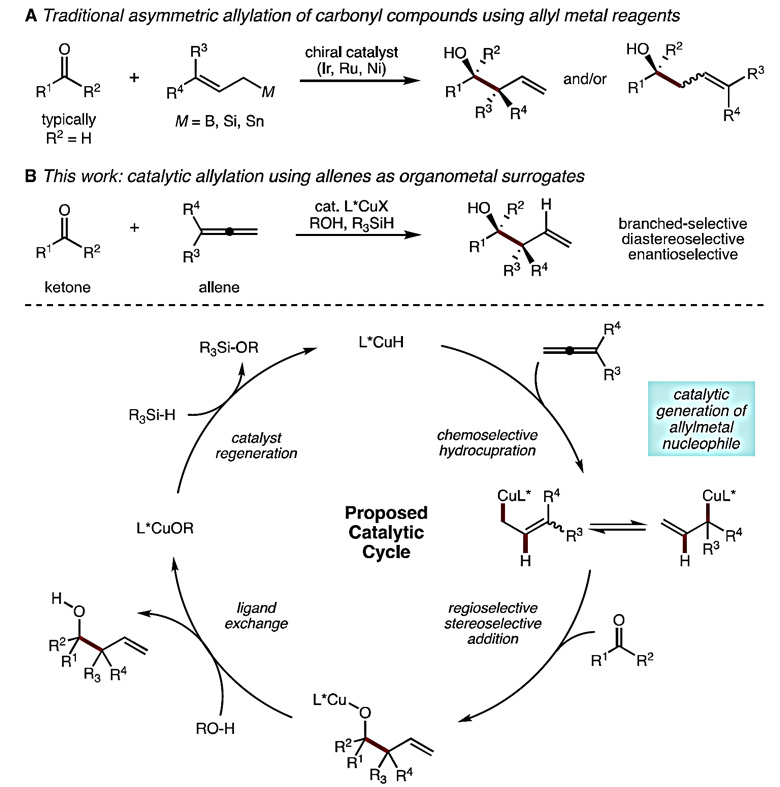
图1. 过渡金属催化酮类化合物的不对称烯丙基化反应。图片来源:J. Am. Chem. Soc.
作者首先以苯乙酮1a与环己基联烯1b作为模板底物对反应条件进行筛选,考察不同配体、溶剂、反应温度等条件对结果的影响。研究发现,当使用Josiphos型膦配体D,甲苯作为溶剂,反应在0 ℃条件下能以97%的1H NMR收率、14:1的非对映选择性、96%的对映选择性得到高烯丙醇产物1。
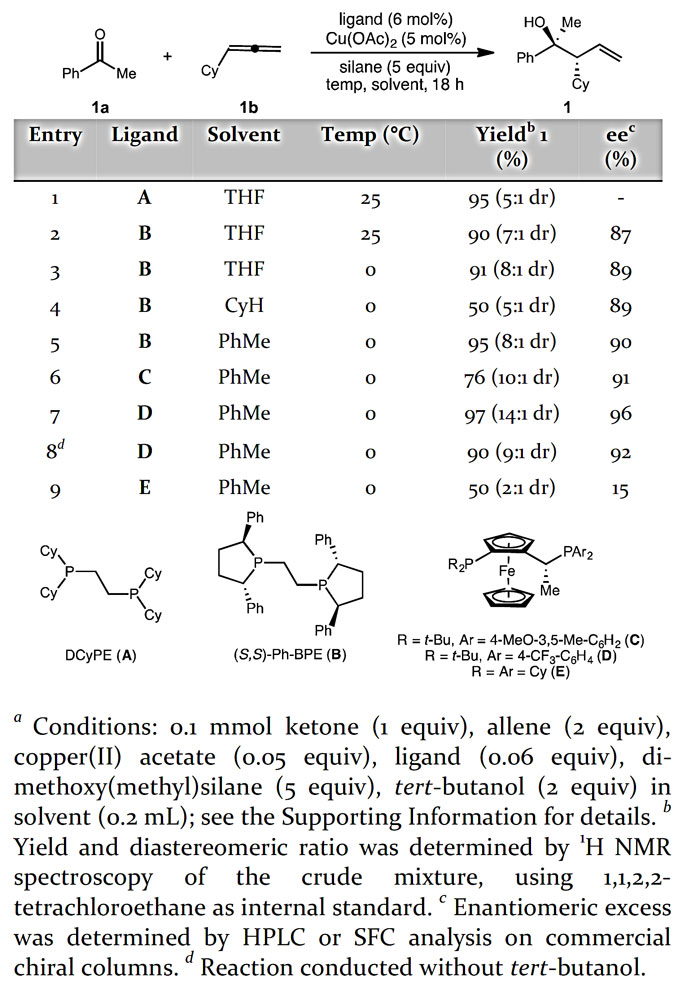
图2. 反应条件的优化。图片来源:J. Am. Chem. Soc.
得到最优条件后,作者将反应的规模扩大到0.5 mmol,对底物的适用范围进行了考察。为了保证产物的收率和选择性,作者将联烯的用量提高到1.2当量,氢化硅烷DMMS的用量提高到2当量,首先考察底物酮的适用范围。芳香环上不同的取代基如酯基、羟基、甲氨基、甲硫基、甲氧基等都可以在该体系中兼容,除此之外,芳香杂环如吡啶、吡唑、噻吩和吡咯等对反应不会造成负面的影响。
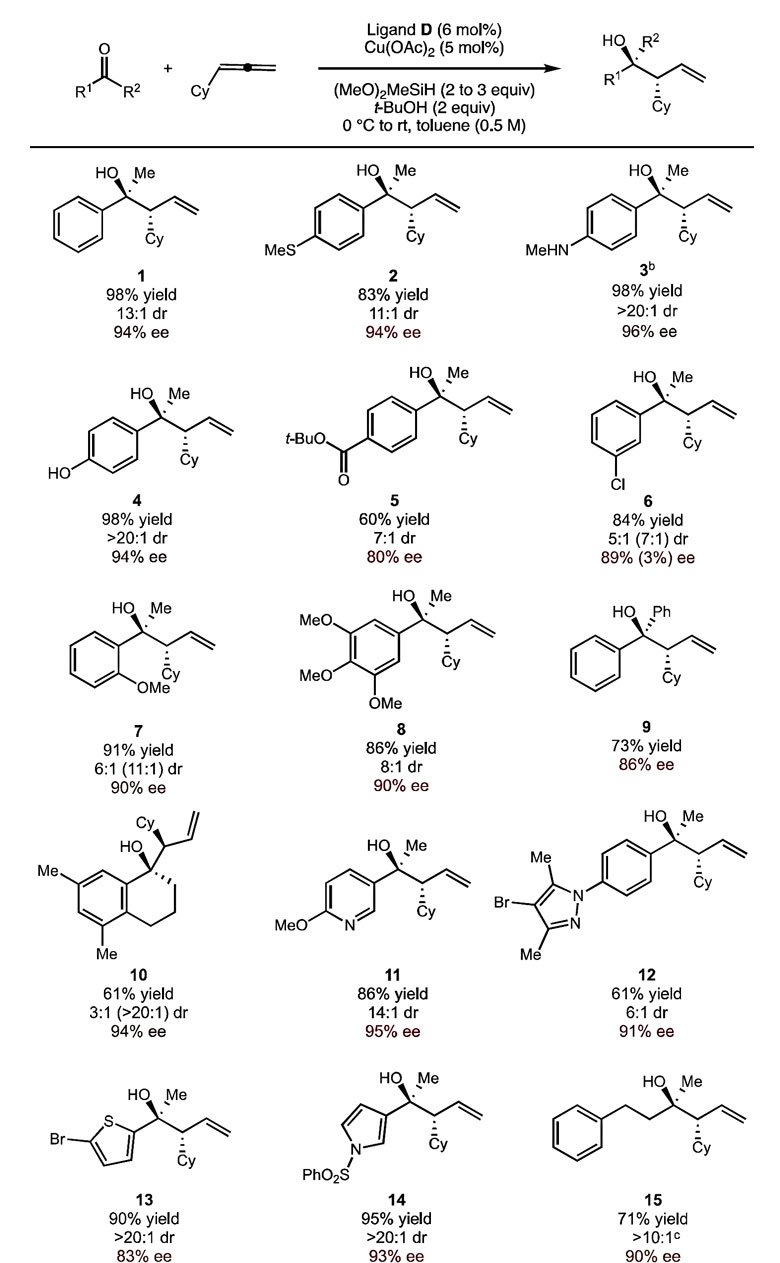
图3. 底物酮适用范围的考察。图片来源:J. Am. Chem. Soc.
随后,作者考察了不同联烯底物对反应结果的影响。非支链联烯、1,1-双取代的联烯都能作为亲核试剂前体顺利参与反应,修饰的官能团如酯基、羟基、二级酰胺基团等都可以很好地兼容。此外,联烯中修饰含氮芳香杂环也可作为合适的底物发生反应,低沸点的气体联烯参与反应时只能获得中等的对映选择性。
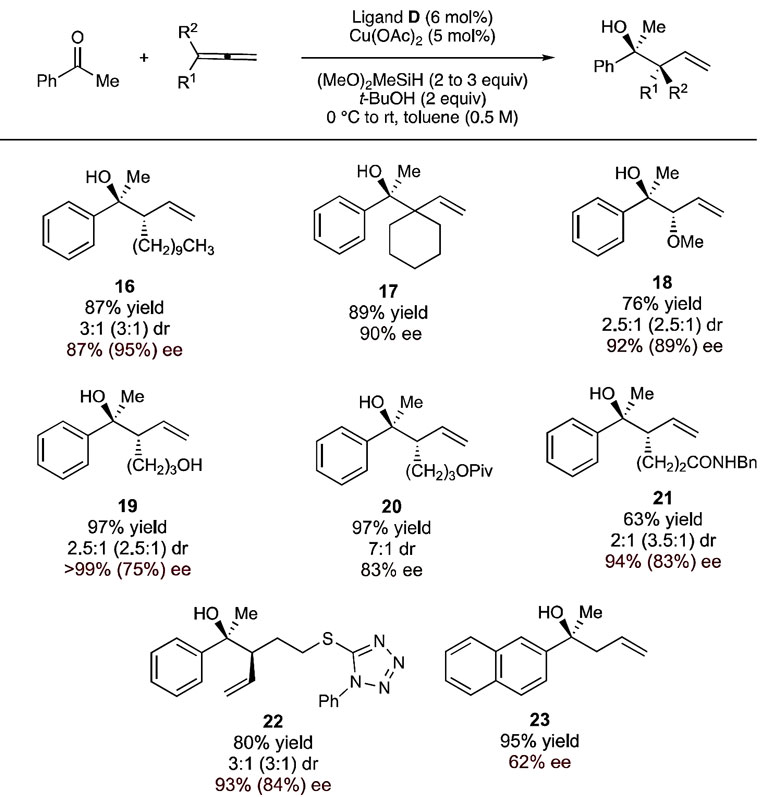
图4. 底物联烯适用范围的考察。图片来源:J. Am. Chem. Soc.
为了验证在图1B中提出的机理,作者选择非手性的DCyPE作为配体,设计了一系列的NMR实验。他们利用膦配体配位的CuOAc与化学计量的氢化硅烷DMMS混合可以得到相应的CuH物种I。体系中加入过量的环己基联烯可进一步发生插入反应,得到线型烯丙基铜物种II,该物种通过DFT计算证实在所有异构体中能量最低。II可以与苯乙酮反应得到烷氧基铜物种III,后者与氢化硅烷混合可以重新生成CuH物种I。作者还通过31P NMR观察催化过程中每一种可能的中间体,进一步试图确定哪种中间体是反应的休眠态。体系在δ = 10.7 ppm处出现特征单峰,作者推断该化学位移对应于烯丙基铜物种II。因此,作者认为烯丙基铜对酮的加成过程不可逆,是立体选择性决定步骤,而且还是反应的决速步。
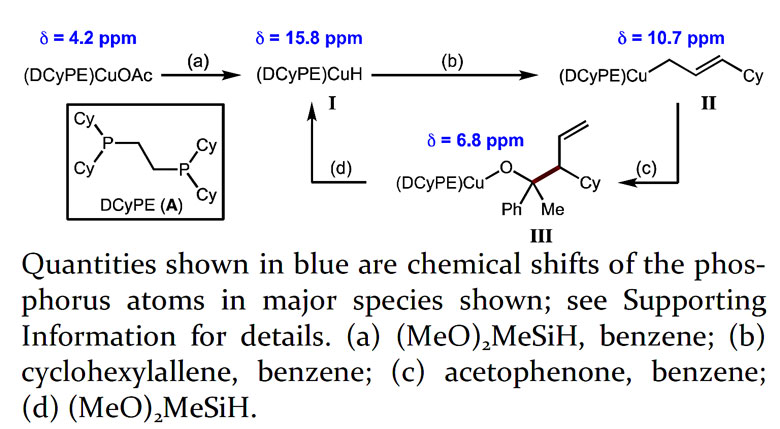
图5. 31P NMR跟踪观察反应中相关的中间体。图片来源:J. Am. Chem. Soc.
——总结——
Stephen Buchwald教授发展了CuH催化的末端联烯对酮的不对称烯丙基化反应。反应可以在温和的条件下进行,具有良好的收率与立体选择性,官能团兼容性好。作者还利用31P NMR跟踪反应中可能经历的中间体,从而验证了提出的机理,并确定了反应的决速步。
化学慧定制合成事业部摘录







