 图式1 铜催化2-卤代芳基硫脲串联反应合成芳基氰胺 图式1. Copper-catalyzed cascade reaction of 2-haloarylth-ioureas for the synthesis of arylcyanamides
图式1 铜催化2-卤代芳基硫脲串联反应合成芳基氰胺 图式1. Copper-catalyzed cascade reaction of 2-haloarylth-ioureas for the synthesis of arylcyanamides 早期, 合成氰胺的方法主要基于NH-胺1和氰化溴(2)的亲核取代反应[7](Eq. 1) 及von Braun反应[8](Eq. 2).后来Parry等[9]又发展了固载化的胺和氰化溴的反应实现固相合成氰胺.这些方法原料简单易得、操作简便, 但存在比较突出的缺陷, 以剧毒的氰化溴为氰基化试剂, 且反应受电子和位阻效应影响严重, 位阻大或者贫电子的胺, 反应产率低.
由于氰化溴的剧毒性, 限制了上述合成方法的推广应用, 因此发展以低毒性化合物为原料的合成方法已成为氰胺合成亟待解决的问题.为此, 近十年来合成化学家们发展了各种以低毒性化合物为原料的合成方法.
2009年Satyanarayan等[10]以氨基二硫甲酸的铵盐6为起始原料, 通过“一锅煮”三步反应直接合成氰胺7 (Eq. 3).氨基二硫甲酸的铵盐首先在三乙胺和碘作用下发生还原脱硫反应生成异硫氰酸酯, 异硫氰酸酯接着和氨进行亲核加成和还原脱硫反应生成氰胺.该反应避免使用高毒性的氰基化合物为原料, 是较环保的合成方法, 但该反应只适用于合成一取代氰胺.
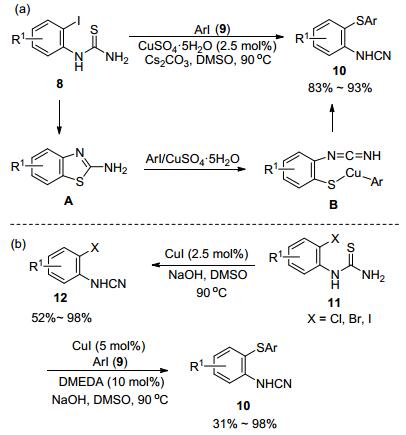
2010年, Punniyamurthy等[11]报道了CuSO4·5H2O催化2-碘芳基硫脲(8)和芳基碘(9)串联反应, 高效合成2-芳基硫代芳基氰胺(10) (Scheme 1, a).作者提出以下反应机理:首先, 2-卤代芳基硫脲在铜催化下进行分子内C—S偶联反应生成噻唑A.接着, 芳基碘和铜发生氧化加成反应, 并进一步和噻唑进行反应产生中间体B.最后B发生还原消除反应即可生成目标产物.几个月后, Patel课题组[12]又意外发现CuI催化2-卤代芳基硫脲(11)反应合成芳基氰胺类化合物(10) (Scheme 1, b).在配体协助下, CuI催化2-卤代芳基硫脲和碘代芳烃反应生成2-芳基硫代芳基氰胺.该催化体系对底物具有良好的兼容性, 2-碘代和2-溴代芳基硫脲都能适应反应.此外, 他们还发现, 在无配体条件下CuI催化2-卤代芳基硫脲的反应则直接发生脱硫反应生成2-卤代芳基氰胺12.
 图式1 铜催化2-卤代芳基硫脲串联反应合成芳基氰胺 图式1. Copper-catalyzed cascade reaction of 2-haloarylth-ioureas for the synthesis of arylcyanamides
图式1 铜催化2-卤代芳基硫脲串联反应合成芳基氰胺 图式1. Copper-catalyzed cascade reaction of 2-haloarylth-ioureas for the synthesis of arylcyanamides
2014年, Chen等[13]以毒性稍小的三甲基氰硅烷(TMSCN)为氰基化试剂, 发展了NaOCl/H2O促进二级胺1的亲电氰基化反应制备二取代氰胺3, 反应能够生成中等偏上的产率(Scheme 2). TMSCN先和NaOCl及H2O发生反应原位生成氰基氯(A), 接着和胺发生亲核取代反应产生目标产物.
 图式2 胺和TMSCN偶联反应合成氰胺 图式2. Coupling reaction of amines and TMSCN for the synthesis of cyanamides
图式2 胺和TMSCN偶联反应合成氰胺 图式2. Coupling reaction of amines and TMSCN for the synthesis of cyanamides
2014年Chien等[14]发展了氰14和羟胺15的两步一锅煮反应合制备一取代氰胺16, 反应生成51%~95%的产率(Eq. 4).羟胺和氰基化合物首先进行亲核加成反应生成脒肟, 接着在碱和磺酰氯的作用下发生Tiemann重排脱水生成氰胺.作者还发现咪肟的Tiemann重排和水解一锅煮反应, 实现对脲类化合物的合成.
2016年Morrill等[15]以胺1和三氯乙氰17为原料, 通过一锅煮两步反应实现对氰胺3的直接合成(Eq. 5).胺和三氯乙氰先进行亲核加成, 接着在在碱性条件下发生脱氯仿反应生成二取代氰胺.该反应可生成中等偏上的产率, 但底物适用范围窄, 只有二级胺适应于该反应.此外, 作者还将反应应用于合成具有抗PDE4活性的氰胺.
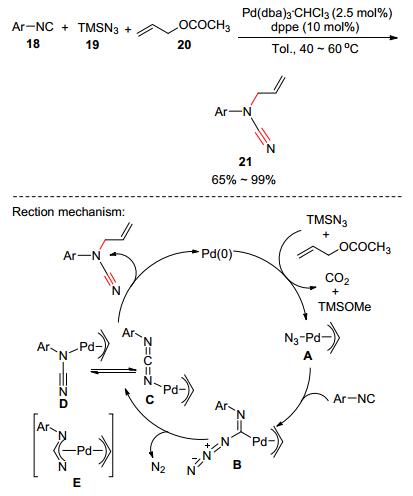
过渡金属催化多组分反应同样也已被应用于合成氰胺类化合物, 2001年Yamamoto课题组[16]发展了钯催化异氰18、三甲基硅叠氮19和烯丙醇酯20三组分反应高效合成氰胺21 (Scheme 3).反应可以实现一步构建多个化学键, 高产率生成芳基烯基氰胺.同时, 反应受底物的电子和位阻效应影响小, 且对氰基、酯基和氯等官能团都有良好的兼容性.基于实验结果, 作者提出了以下反应机理:烯丙醇酯、三甲基硅叠氮和钯催化剂先反应生成叠氮π-烯丙基钯A.叠氮π-烯丙基钯接着和异氰反应生成π-烯丙基钯络合物B, B发生类似Curtius重排的反应释放出氮气产生中间体C, C转化成互变异构体D(或E).最后, D(或者E)发生还原消除反应即可生成目标产物和钯催化剂.
 图式3 钯催化异氰、三甲基硅叠氮三组分反应合成氰胺 图式3. Palladium-catalyzed three-component reaction of isocyanides, allyl carbonate and trimethylsilyl azide for the synthesis of cyanamides
图式3 钯催化异氰、三甲基硅叠氮三组分反应合成氰胺 图式3. Palladium-catalyzed three-component reaction of isocyanides, allyl carbonate and trimethylsilyl azide for the synthesis of cyanamides
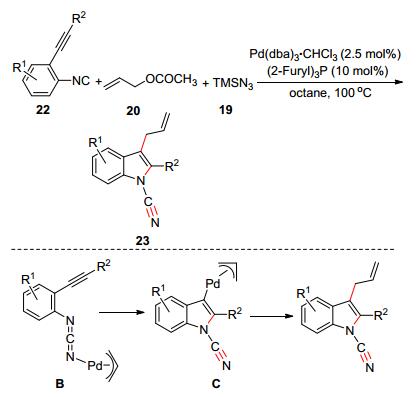
接下来, 他们以邻位炔基化的异氰苯22为原料, 在高温条件下, 成功将反应应用于合成N-氰基吲哚类化合物(Scheme 4)[17].该反应可以实现一步构建多个化学键直接合成吲哚类化合物.其反应过程和非邻位炔基的异氰反应相似, 经过多步反应产生中间体B, B接着发生连续的分子内碳碳三键氨基钯化和还原消除反应生成最终产物.
 图式4 钯催化邻炔基芳基异氰、烯丙醇酯和三甲基硅叠氮三组分反应合成N-氰基吲哚 图式4. Palladium-catalyzed three-component reaction of 2-alkynylaryl isocyanides, allyl carbonate and trimethylsilyl azide for the synthesis of N-cyanoindoles
图式4 钯催化邻炔基芳基异氰、烯丙醇酯和三甲基硅叠氮三组分反应合成N-氰基吲哚 图式4. Palladium-catalyzed three-component reaction of 2-alkynylaryl isocyanides, allyl carbonate and trimethylsilyl azide for the synthesis of N-cyanoindoles
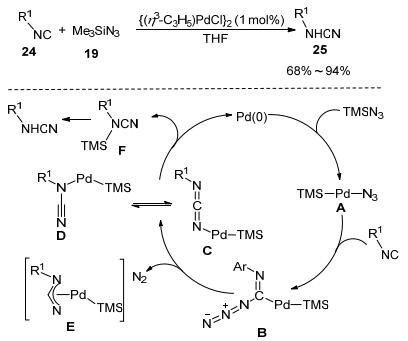
后来Yamamoto课题组[18]又发现钯催化异氰24和三甲基硅叠氮(19)的反应也可以直接合成一取代氰胺25 (Scheme 5).该反应可应用于合成芳基氰胺和脂肪族氰胺, 生成中等偏高的产率, 对酯、氰基、炔基等官能团都具有良好的兼容性.反应可能经历以下反应历程:钯和TMSN3发生氧化加成反应产生钯络合物A, 再和异氰进行加成反应生成中间体B. B发生类似Curtius重排的反应释放出氮气产生C, C转化成互变异构体D(或E), D(或E)发生还原消除产生F, F最后在硅胶柱色谱纯化过程中脱去三甲基硅生成目标产物.
 图式5 钯催化异氰和三甲基硅叠氮反应合成氰胺 图式5. Palladium-catalyzed reaction of isocyanides and trimethylsilyl azide for the synthesis of cyanamides
图式5 钯催化异氰和三甲基硅叠氮反应合成氰胺 图式5. Palladium-catalyzed reaction of isocyanides and trimethylsilyl azide for the synthesis of cyanamides
除了上述构键氰胺官能团的合成方法, N, N-二取代氰胺还可通过NH-氰胺和碘化物的偶联反应快速合成.
2012年, Louie等[19]证实钯催化NH-氰胺26和卤代烃类27的C—N偶联反应可以简便合成二芳基氰胺28 (Eq. 6).芳基氰胺和脂肪族氰胺都适应反应, 生成中等偏上的产率.反应受卤代芳烃的位阻效应影响较大, 大位阻2-甲基苯基溴和2, 4, 6-三甲基苯基溴的反应没有任何的产物生成.
后来, Cui等[20]发现芳香氰胺(29)和六氟磷酸二芳基碘盐(30)可以在碱性无过渡金属条件下发生C—N偶联反应生成二取代氰胺31 (Scheme 6).反应在室温下进行, 条件温和, 但为了避免氰胺被氧化, 反应需要惰性气体的保护.另外, 作者还发现氰胺可以先和六氟磷酸二芳基碘盐进行反应生成芳基化氰胺, 芳基化氰胺接着在酸和铜共同作用下和三氟甲磺酸二芳基碘盐及H2O发生三组分反应实现一锅煮合成多取代脲类化合物32.
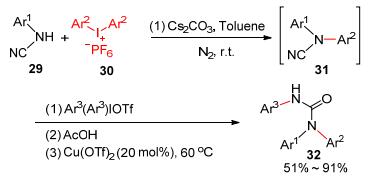 图式6 氰胺和二芳基碘盐偶联反应定制合成氰胺和脲 图式6. Cross coupling of NH-cyanamides and diaryliodoniums for the synthesis of cyanamides and ureas
图式6 氰胺和二芳基碘盐偶联反应定制合成氰胺和脲 图式6. Cross coupling of NH-cyanamides and diaryliodoniums for the synthesis of cyanamides and ureas 






