 图式1 铜催化机理 Scheme1. Copper-catalyzed mechanism
图式1 铜催化机理 Scheme1. Copper-catalyzed mechanism 2012年Bantreil等[4]用氧化铜作催化剂, 叔丁基过氧化氢 (TBHP) 作氧化剂, 醇和胺的盐酸盐在80 ℃下反应4 h, 得到酰胺 (Eq. 1).该反应中会产生副产物酸, 加入过量的醇可避免因副产物的生成而减少酰胺的产率, 且副产物酸在后处理时容易除去.含手性原料参与反应, 生成酰胺的选择性也相当好.
反应机理如Scheme 1: A分子内β-氢脱掉生成苯甲醛和叔丁醇同时生成有活性的二价铜, 生成的苯甲醛和铜离子络合物和自由胺、碳酸钙反应生成中间体B, 在过氧化物的存在下B进化成C, 接着β-氢离去生成酰胺 D, 并且再次生成二价铜催化剂.实验表明第一次催化循环即氧化成醛是比第二次催化循环即醛的酰胺化要慢.
 图式1 铜催化机理 Scheme1. Copper-catalyzed mechanism
图式1 铜催化机理 Scheme1. Copper-catalyzed mechanism
2013年Ghosh小组[5]提出用硝酸铁作催化剂, 在空气中合成酰胺的方法 (Scheme 2).该反应分两步进行, 首先铁盐和2, 2, 6, 6-四甲基哌啶-氮-氧化物 (TEMPO) 联合作催化剂, 空气中的氧作为氧化剂, 氧化醇到醛; 第二步醛和胺的盐酸盐在叔丁基过氧化氢 (TBHP) 作氧化剂, 碳酸钙作碱的条件下反应得到酰胺.用纯氧作氧化剂存在一定的安全隐患, 改用大气中的氧气, 对反应亦没有影响.但同时出现新的问题, 由于是开放系统, 反应液中的溶剂处在暴露中, 就会不断向大气中挥发, 对环境和人身都会造成一定伤害, 急需改善.
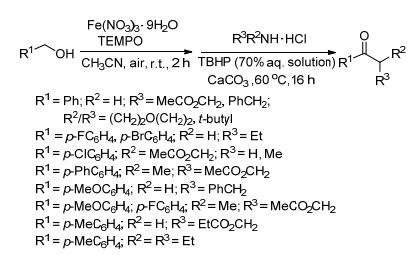 图式2 铁催化生成酰胺 Scheme2. Amide formation by iron catalysts
图式2 铁催化生成酰胺 Scheme2. Amide formation by iron catalysts
机理如Scheme 3: Fe-TEMPO介导氧化醇生成醛, 然后和胺在原位发生反应形成半缩醛中间体, 进一步通过游离基机理被Fe-TBHP催化氧化.
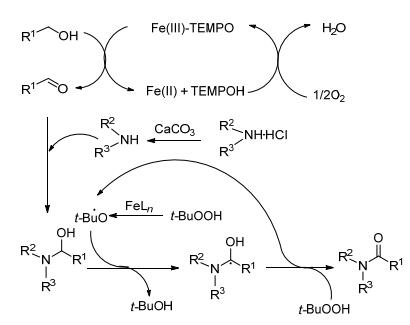 图式3 (Fe-TEMPO) 催化氧化氨化机理 Scheme3. A mechanism for (Fe-TEMPO)-catalysed tandem oxidative amidation
图式3 (Fe-TEMPO) 催化氧化氨化机理 Scheme3. A mechanism for (Fe-TEMPO)-catalysed tandem oxidative amidation
2014年Islam等[6]提出用聚合物锚定二价钌作为制备二级酰胺的催化剂 (Eq. 2).醇和胺在该催化剂作用下, 碳酸铯作碱, 3-甲基-2-丁酮作氢的接受体, 正丁醇作溶剂回流18 h得到酰胺.醇中甲氧基的引入会使得反应收率明显提高 (87%~96%), 且几乎没有副产物.催化剂可以重复使用六次而不失活性, 在工业上的应用有着光明的前景. Hong等[7]报道N杂环卡宾钌配合物被用于催化醇和胺在无碱的条件下合成酰胺, 反应受所带基团的电子效应的影响明显.反应条件对于仲胺参与反应不是很适用, 需要加入催化量的碱, 促进醇和胺的反应.
2015年Rokade等[8]提出用高氯酸铜作催化剂, 催化氧化α, β-不饱和烯醇和叠氮三甲基硅烷 (TMSN3) 反应生成α, β-不饱和酰胺 (Eq. 3).叠氮三甲基硅烷作为氮的来源, 2, 3-二氯-5, 6-二氰基-1, 4-苯醌 (DDQ) 作氧化剂, 醋酸和水作溶剂, 在室温下和醇反应1 h得到酰胺.该工艺是专门为α, β-不饱和烯醇向不饱和酰胺转化所设计, 收率很好.但反应中使用的TMSN3是有毒的危险品, 对环境和人身都有危害, 不适宜在放大工艺中使用.
2016年, Hull等[9]用金属铑作催化剂, 醇和胺一锅法得到酰胺.同年Hong等[10]提出一种高效、无金属催化的直接由醇合成酰胺的方法 (Eq. 4).偶氮化合物作为氮的来源和醇反应, 叔丁基过氧化氢作氧化剂, 乙腈作溶剂, 在120 ℃下反应24 h得到相应的酰胺, 电子效应对该反应并没有明显的影响.苯系醇和脂肪族甚至萘系醇参与反应都有不错的收率.
反应机理如Scheme 4:苯甲醇先被过氧化物氧化成醛, 再转变成自由基, 偶氮苯和自由基反应生成中间体, 再吸引叔丁基过氧化氢上的氢原子得到另一中间体, 最后水解得到酰胺.
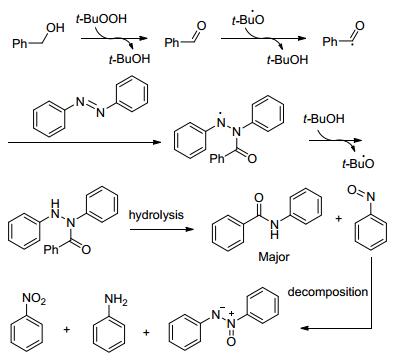 图式4 反应机理 Scheme4. Proposed mechanism
图式4 反应机理 Scheme4. Proposed mechanism 






