多羟基取代的化合物广泛存在于天然产物及合成的分子中,通常具有良好的生物活性。从合成化学的角度来看,醇类化合物是羰基化合物的重要前体,进而转化为一系列含氧或含氮官能团的衍生物。对于多羟基化合物进行特定羟基的选择性氧化无疑具有非常重要的意义,而传统的氧化方法无法满足这一过程中对反应性和选择性的要求,反应过程中常伴随着竞争的副反应发生。最近,美国加州大学伯克利分校的著名有机化学家John F. Hartwig教授 在Nature Chemistry上报道了Ru催化剂作用下多羟基化合物的选择性氧化反应,反应可以仅对多个未保护羟基中的一个进行选择性氧化,产物经过后续的转化可以引入含氮官能团。此外,反应通过分步法或者可逆的氧化、还原过程还可以实现选择性的羟基差向异构化。

John F. Hartwig教授。图片来源:UC Berkeley
人们发展了多肽类催化剂可以对复杂多元醇进行选择性的羟基酰化、磷酸化或磺酰化,还包括铑卡宾络合物选择性对多元醇羟基的插入反应。然而这些反应仅可对相应的羟基进行修饰,无法取代羟基形成新的C-C键。尽管通过催化的方式实现多元醇选择性氧化的方法已有报道,然而反应会优先发生一级醇的氧化,对于如果实现位阻较大的二级醇选择性氧化,一直以来都充满挑战。基于对文献的调研,作者设想以酮作为氢转移受体,利用脱氢氧化的方法,使二级醇相比于一级醇优先发生氧化。通过对一系列催化体系进行筛选,作者选择弱配位的阴离子和位阻较小、具有强给电子能力的膦配体配位的Ru(II)作为催化剂(图1a)。利用该Ru(II)催化剂,位阻较大的二级醇可以在丙酮、三氟苯乙酮、1,4-环己二酮作为氢转移受体的条件下发生氧化得到酮(图1b)。作者分别对单一二级醇氧化、一级醇和二级醇混合竞争氧化进行考察,表明该催化体系中,二级醇的反应活性要明显高于一级醇(图1c)。与此同时,利用异丙醇作为氢转移给体,在Ru催化剂的作用下位阻较大的酮也能发生有效的还原(图1d)。
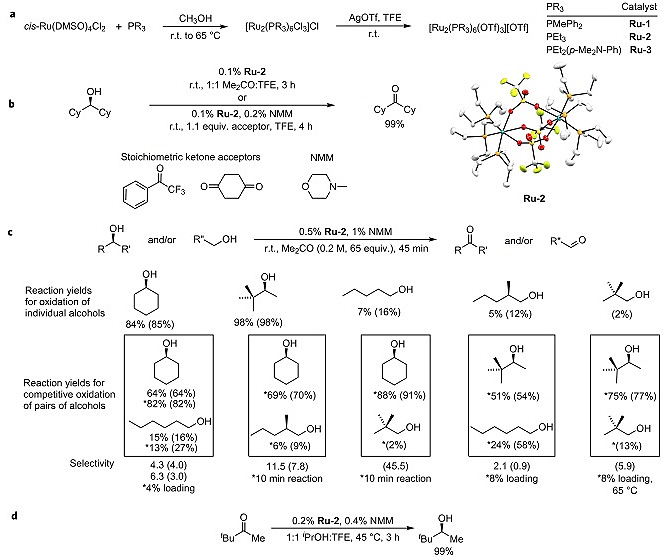
图1. 催化剂的合成和二级醇的选择性氧化。图片来源:Nat. Chem.
为了证明该方法学的实用性,作者选择不同含多羟基结构的天然产物及三种天然产物的甲酯衍生物作为底物,通过氢转移的过程实现特定羟基的选择性氧化(图2)。这些天然产物包括类固醇类、双萜类、倍半萜类、环烯醚萜类、糖类、生物碱类和大环内酯类等,具有很好的代表性。图2a中的氧化结果表明二级醇氧化先于一级醇;图2b的氧化结果则反映了当天然产物中存在多个二级醇羟基时反应的选择性,基于不同二级醇羟基的立体电子效应,Ru催化剂倾向于与富电子、位阻更小的二级醇羟基作用。对于发生氧化反应时热力学过程相对不利的化合物1o和1p,反应需要使用氧化电势更高的三氟苯乙酮作为受体。对于1q,相比于其他二级醇羟基的氧化,反应使用双齿膦配体配位的Ru催化剂可优先发生烯丙基二级醇的异构化。
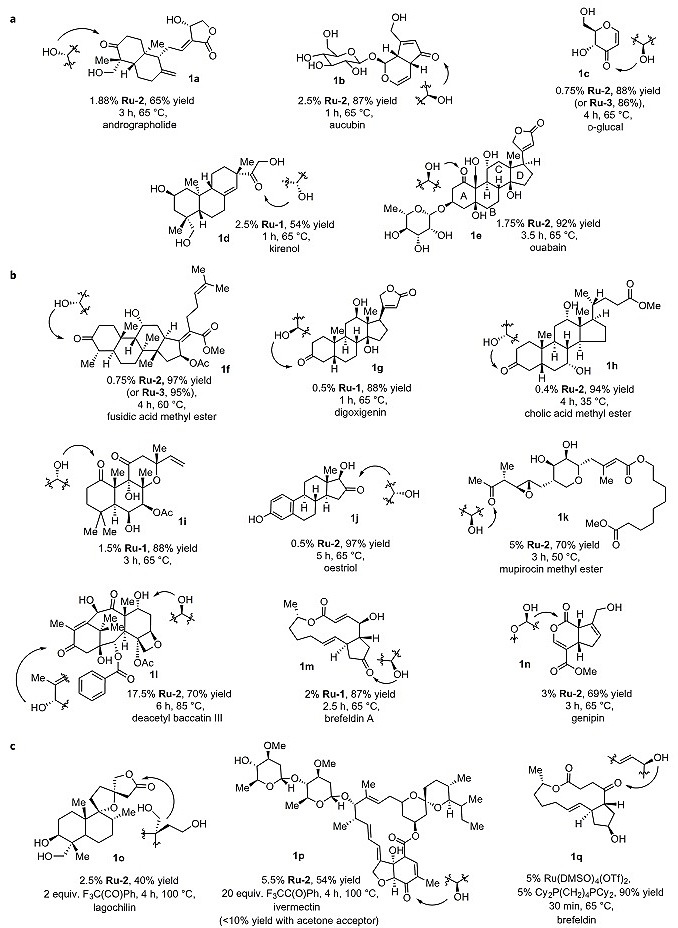
图2. 多羟基天然产物发生选择性氧化。图片来源:Nat. Chem.
对于以上羟基发生选择性氧化的过程,作者还对不同天然产物进行了构象分析。化合物六元环中存在的1,3-相互作用,降低了相关位点发生氧化的速率,因而使图中红色标记的位点更容易发生反应(图3)。
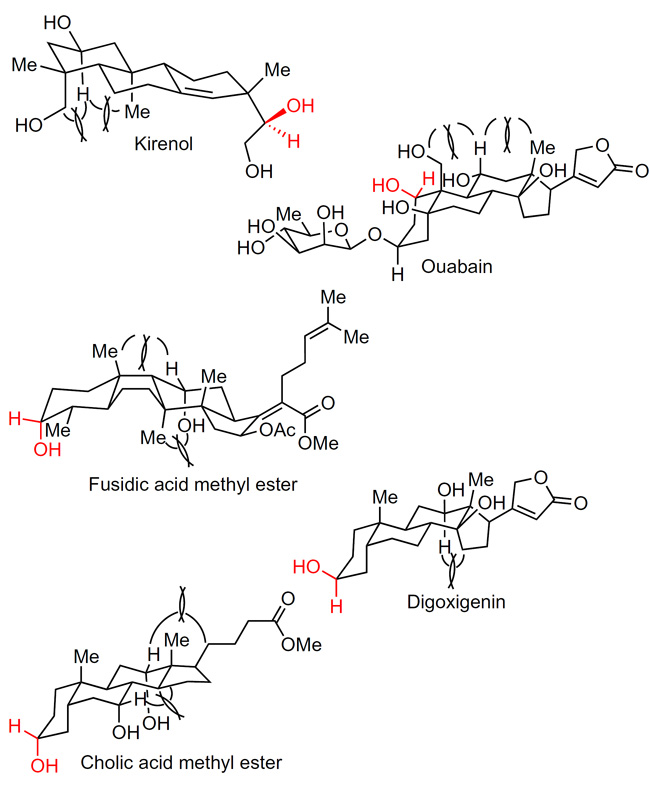
图3. 六元环中的1,3-相互作用影响醇羟基氧化的选择性。图片来源:Nat. Chem.
作者进一步从发生选择性氧化后的羰基化合物出发,经多步化学转化,最后再经过还原胺化成功地将含氮官能团引入到天然产物andrographolide、fusidic acid methyl ester、D-glucal和oestriol中(图4)。
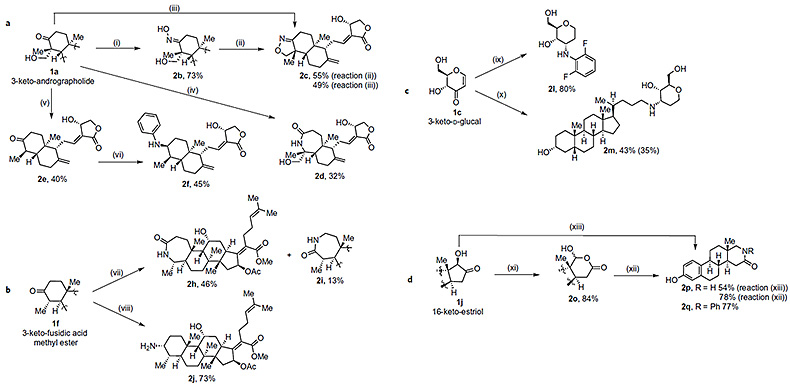
图 4. 多羟基天然产物的氧化和胺化。图片来源:Nat. Chem.
作者发展的方法不仅能以酮作为氢转移受体使位阻较大的醇发生氧化,还可以利用异丙醇作为氢转移给体实现位阻较大的酮的还原过程。这样的结果暗示反应可在Ru催化下实现多羟基化合物中特定羟基的差向异构化。比如,作者从去西地酸甲酯衍生物氧化得到的酮出发,可以通过Ru催化还原以80%的收率得到3-epi-fusidic acid methyl ester (4a),通过类似的方法能以90%的收率得到1-epi-ouabain (4b)。其中醇氧化并发生还原的差向异构化过程可在无氢转移受体存在的情况下通过一步反应直接实现(图5)。
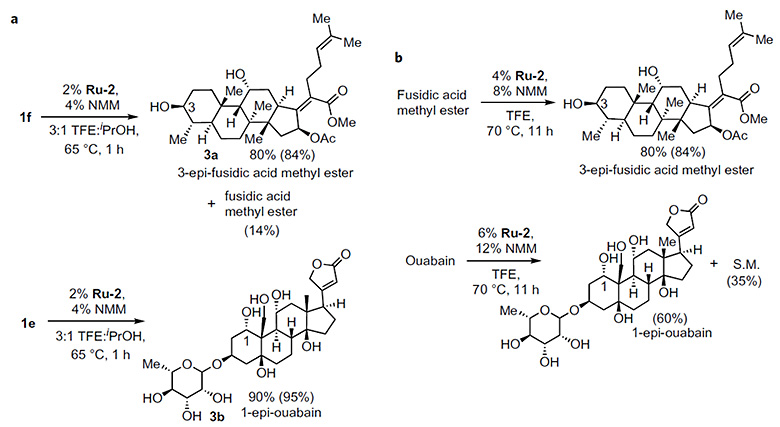
图5. 多羟基化合物的差向异构化图片来源:Nat. Chem.
——总结——
John F. Hartwig教授发展的Ru催化剂参与的氢转移氧化策略,不仅可以高效、选择性地实现多羟基天然产物中特定二级醇羟基的选择性氧化,并且可通过生成的酮羰基进一步转化,在相应位点引入含氮官能团。该反应可与生源定制合成过程有机结合,构建更为丰富的分子骨架结构。







